Дослідники вперше відновили функцію мітохондріальної ДНК у клітинах пацієнта, використовуючи нову техніку редагування генів (не CRISPR).
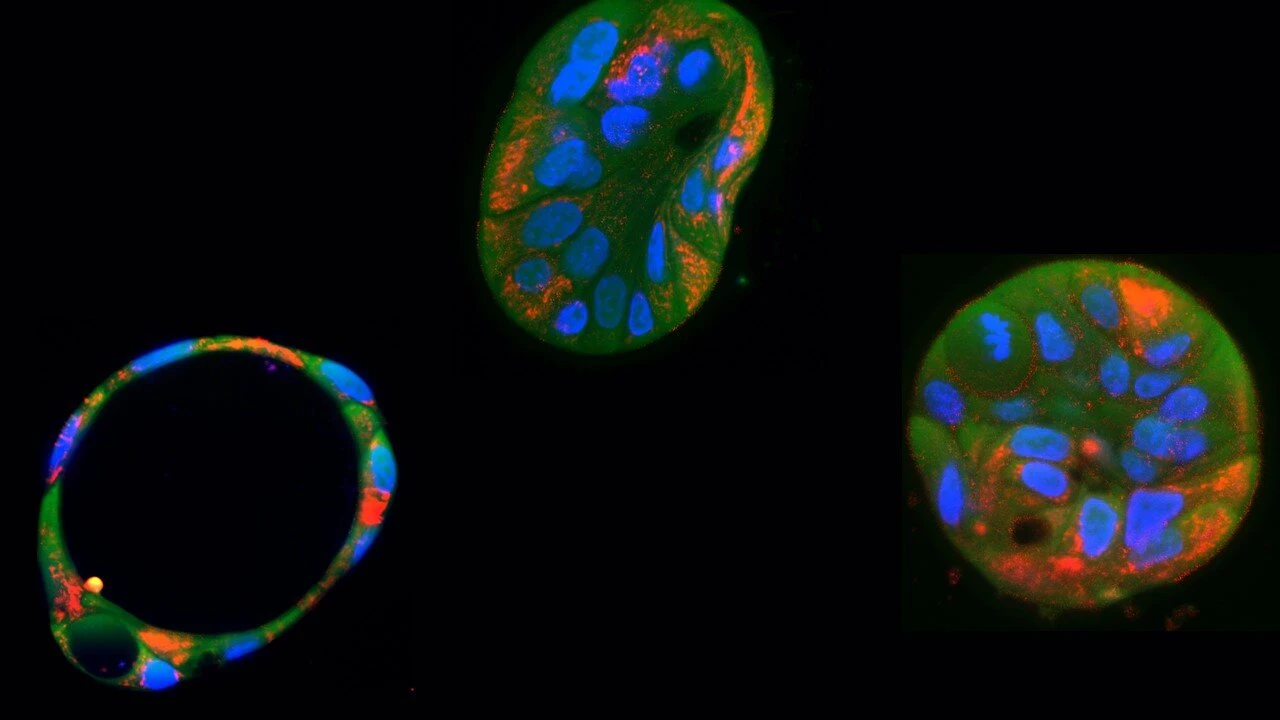
Вчені з Нідерландів зробили важливий крок назустріч лікуванню рідкісних мітохондріальних хвороб, успішно виправивши небезпечну мутацію в мітохондріальній ДНК пацієнта. Мітохондрії – це органели, відомі як «клітинні електростанції», адже вони перетворюють молекули поживних речовин на енергію у формі АТФ. На відміну від інших органел, мітохондрії мають власну ДНК. Її мутації, що передаються за материнською лінією, можуть спричиняти низку серйозних розладів, які призводять до значних проблем розвитку, метаболізму та неврології.
Інструмент генної інженерії CRISPR революціонізував лікування багатьох генетичних захворювань, однак у своїй традиційній формі він не може ефективно проникати всередину мітохондрій та працювати з їхнім ДНК. У межах нового дослідження вченим вдалося розв’язати цю проблему за допомогою нової техніки генної інженерії. Голландські генетики використали інструмент, відомий як базовий редактор, щоб змінювати літери послідовності мітохондріальної ДНК без розрізання її ниток. Вони застосували тип редактора під назвою DdCBE (редактор цитозину, отриманий з дволанцюгової ДНК-дезамінази токсину А), який може перетворювати цитозин на тимін. Спершу за допомогою DdCBE дослідники ввели в клітини печінки мутацію, яка порушила процес вироблення енергії. Наступним кроком стало виправлення іншої мутації в клітинах шкіри пацієнта з захворюванням, подібним до синдрому Гітельмана, але спричиненим мітохондріальною дисфункцією. Корекція мутації відновила ключові ознаки здорового енергетичного обміну в клітинах.

Щоб наблизитися до клінічних випробувань техніки вчені протестували декілька способів доставки редакторів, аби визначити найбільш безпечний та ефективний. Замість того, щоб вставляти ДНК у клітини за допомогою традиційних плазмід, вони доставили редактори у формі мРНК, інкапсульованих у ліпідні наночастинки. Такий підхід є менш токсичним та ефективнішим. Він також підвищив точність корекції, призвівши до мінімальної кількості ненавмисних змін у ядерній ДНК клітин. Більшість «побічних» змін залишалися в межах мітохондріальної ДНК, що свідчить про високий рівень специфічності методики.
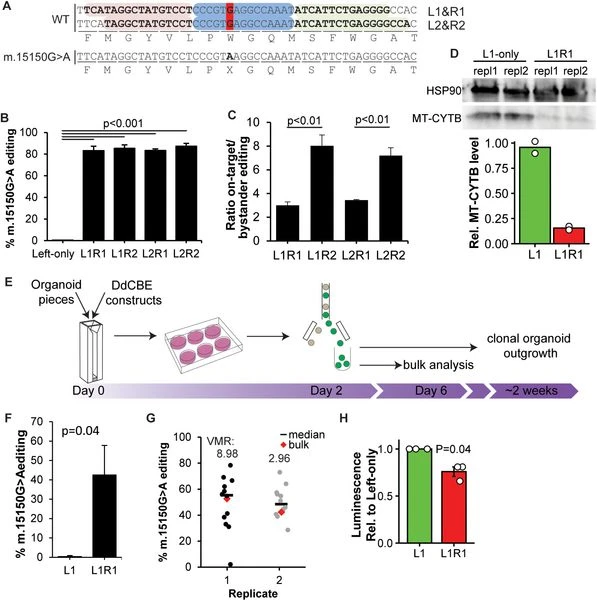
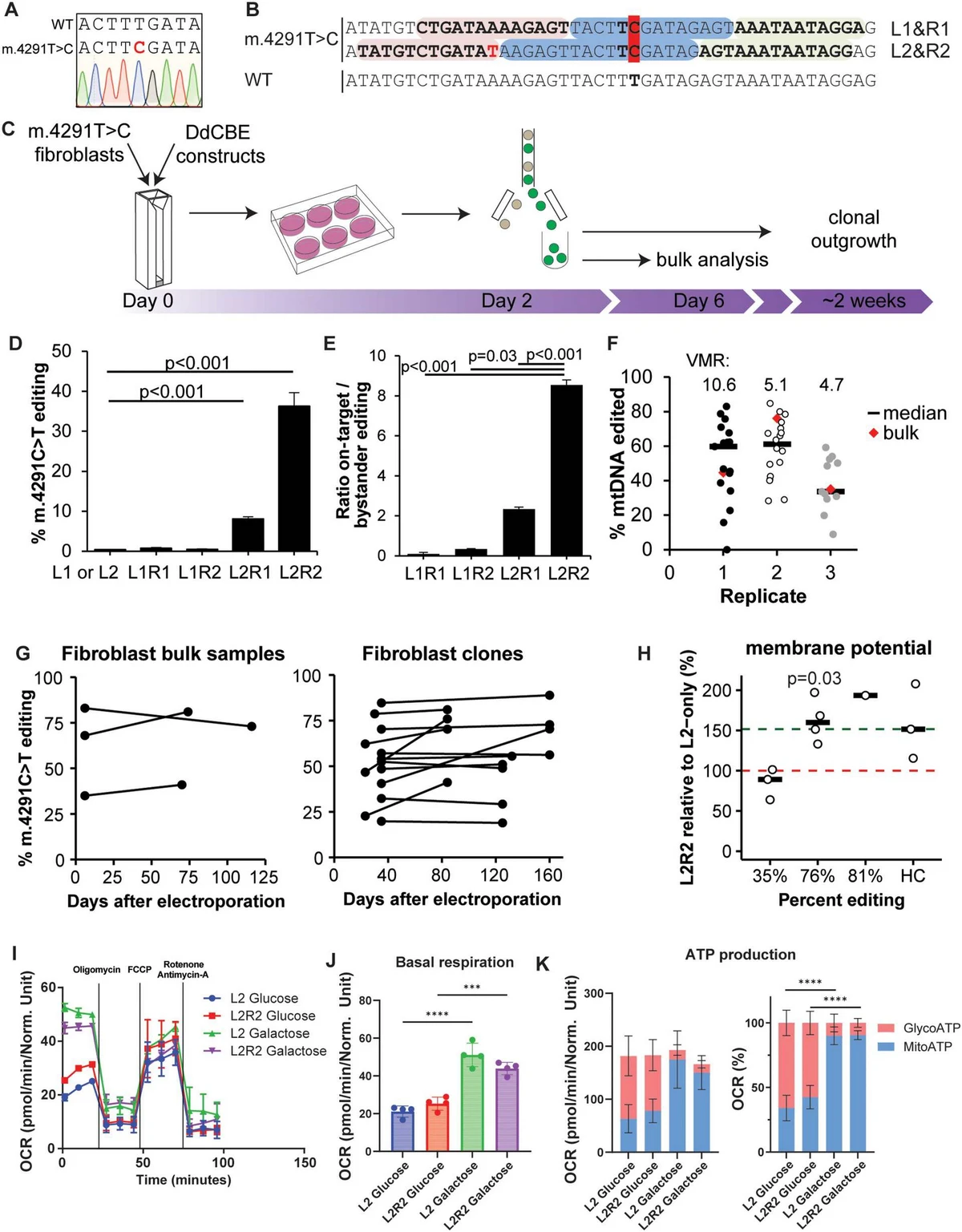
Ця інновація має надзвичайні перспективи в галузі терапії мітохондріальних хвороб, адже вона дозволяє як моделювати захворювання за межами організму, так і редагувати наявні мутації. Дослідники сподіваються, що з розвитком технології вони зможуть розпочати клінічні випробування інструменту DdCBE, а згодом отримати реальний терапевтичний метод лікування мітохондріальних розладів, який допоможе тисячам пацієнтів по всьому світу.
