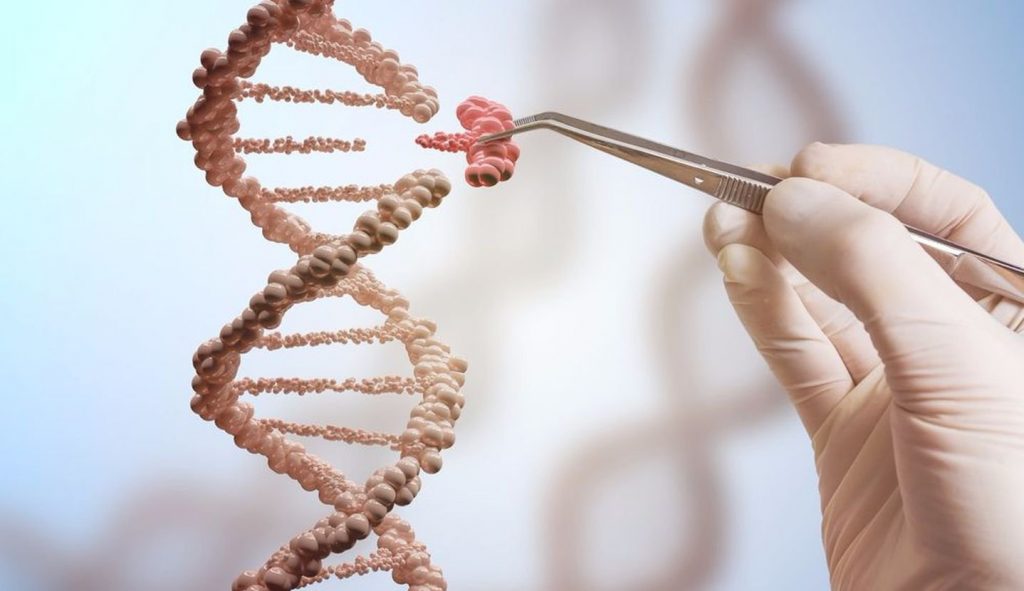
В ноябре 2017 Брайан Мадо стал первым человеком, испытавшим на себе терапию по редактированию генов. У 44-летнего мужчины из Феникса, штат Аризона, в детстве был диагностирован синдром Хантера – редкое генетическое заболевание, связанное с нарушением выработки ферментов, необходимых для расщепления мукополисахаридов. Смысл терапии состоит в замещении повреждённых генов в печени мужчины здоровыми при помощи так называемых «молекулярных ножниц», которые вводят в организм внутривенно. Предварительные результаты терапии показали улучшение состояния Брайана и пяти других пациентов, также получивших инъекции, редактирующие их гены, что ознаменовало революцию не только в медицине, но и на рынке труда.


Постепенно технология применения генной терапии выходит за рамки исследовательских лабораторий, вследствие чего необходимость в специалистах в сфере генной инженерии будет только расти. Правительство Соединённого Королевства ожидает, что к 2030 году только в Британии будет создано более 18 тысяч новых рабочих мест для обслуживания генной и клеточной терапии. По оценкам Бюро статистики труда США количество рабочих мест для инженеров-биомедиков вырастет на 7%, а для исследователей в сфере биотехнологий на 13%, что в сумме составляет около 17,5 тысяч мест.

Генная терапия стремительно развивается и в скором времени станет одной из самых значительных отраслей медицины. Для полноценной деятельности индустрии необходимы специалисты не только медицинской сферы (генетики, молекулярные биологи, вирусологи, биоинженеры, инженеры-биохимики), но и менеджеры, экономисты, юристы и многие другие. Генная индустрия – серьёзный бизнес, на разработку, изучение и множественные эксперименты ежегодно выделяются миллиарды долларов, поскольку в применении терапии, редактирующей гены человека, правительства многих стран видят будущее медицины. На сегодняшний день многие генетически обусловленные заболевания (например, гемофилия или муковисцидоз) неизлечимы и смертельны, существующие технологии позволяют лишь поддерживать жизнь больных и не всегда гарантируют приемлемое качество жизни.
В настоящее время во всём мире проводится около 2700 клинических исследований с использованием генной терапии, направленных на лечение различных заболеваний (рака, мышечной дистрофии, серповидноклеточной анемии и др.). Всемирно известные фармацевтические компании, включая Bayer, GlaxoSmithKline, Pfizer, Merck и Novartis, заинтересованы в успехе подобных клинических испытаний, в связи с чем они активно расширяют штат сотрудников. Работодатели требуют от соискателей высочайшего уровня навыков и знаний и обещают соответственную оплату труда: например, генетик может рассчитывать на сумму от 39 870 до 134 770 долларов в год, а биоинформатик (специалист, который отвечает за толкование генетической информации) будет зарабатывать от 35 620 до 101 030 долларов, согласно данным, предоставленным Национальным Институтом Генетических Исследований.
Потенциал генной инженерии во многих странах ограничен из-за этических вопросов: в Европе любые манипуляции с генами живых организмов – растений, животных, людей – строго контролируются, в США политика правительства более лояльна. Главной этической проблемой считается изменение генов на этапе зачатия или эмбрионального развития – помимо возможности искоренить заболевания, передающиеся по наследству, генная инженерия в будущем позволит выбирать пол, цвет волос и глаз, рост и прочие черты – именно этот факт и вызывает разногласия.
Несмотря на очевидную пользу применения терапии замены дефективных генов, ожидается, что не все пациенты будут чувствовать себя комфортно, позволяя науке вмешиваться в их код ДНК. В таком случае пациенту необходима психологическая поддержка специалиста, который смог бы доступно объяснить все нюансы процедуры и помочь принять решение, учитывая возможные риски – консультанта по генетике. Сегодня их роль в основном заключается в оказании помощи пациентам, столкнувшимся с генетическими заболеваниями и желающими узнать, мутация какого гена стала причиной заболевания и является ли оно наследственным. Данная специальность появилась сравнительно недавно, но по мере развития генной инженерии будет расти необходимость в специалистах этого профиля – к 2026 году количество рабочих мест для консультантов по генетике вырастет на 29%.
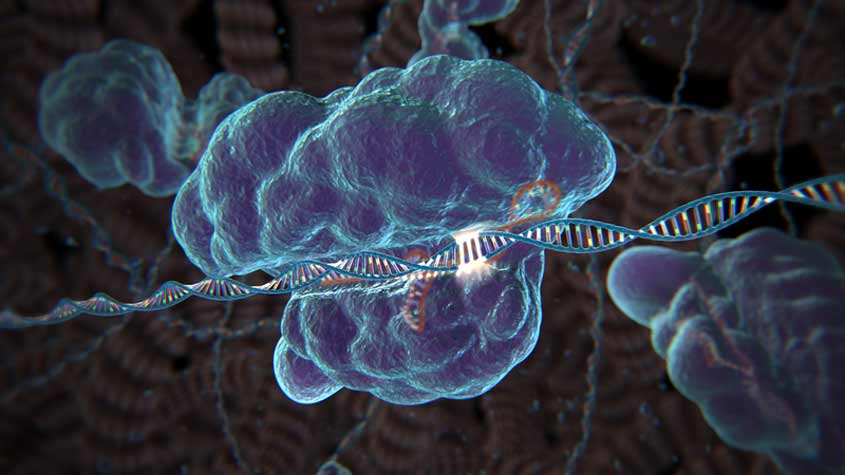
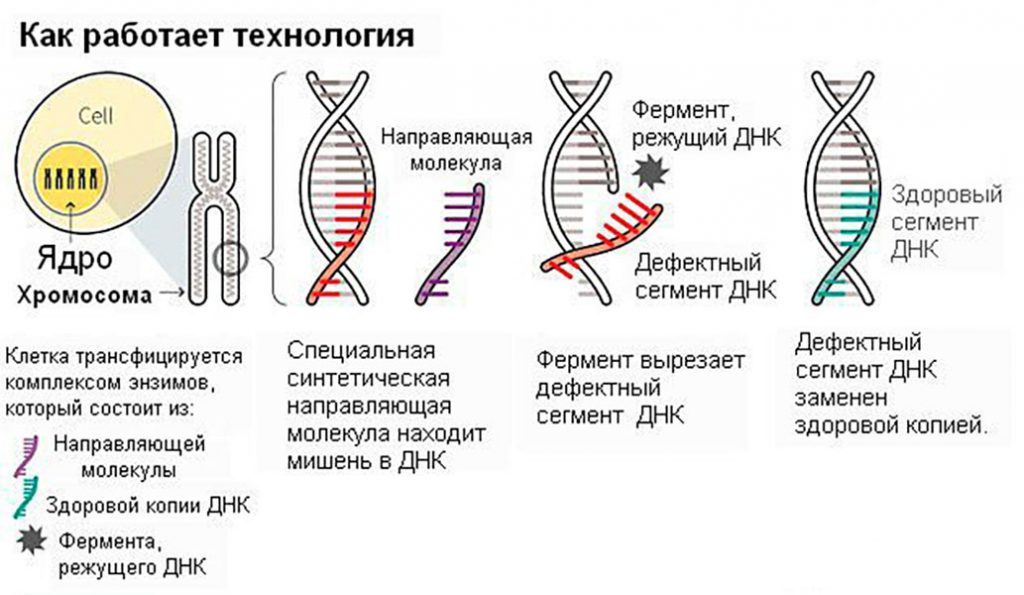
На сегодняшний день лидером в сфере генетической инженерии является Китай, терапия замены дефективных генов была успешно применена на 86 пациентах, больных раком и ВИЧ. В начале 2018 правительство КНР одобрило клиническое исследование с использованием технологии редактирования генов CRISPR-Cas9, в котором примут участие 300 пациентов с различными генетическими заболеваниями. Данная технология позволяет удалять неправильные последовательности генов в клетках высших организмов с помощью иммунной системы бактерий, чтобы впоследствии заменить их здоровыми. CRISPR-Cas9 была открыта 5 лет назад и стала причиной настоящего фурора в медицине, поскольку она стимулировала поиск дефективных генов, отвечающих за различные генетические заболевания.
Источник: www.bbc.com